Simone Scagno 2014
I meccanismi biochimici attraverso i quali si ottiene il controllo sull stato di mineralizzazione e produzione ossea sono molteplici e spesso si incrociano rendendone più difficile la comprensione da parte di studiosi e medici.
Questa complessità è dovuta principalmente al fatto che più fattori devono poter regolare questi fenomeni: gli ormoni devono regolare l’accrescimento e la mineralizzazione ossea durante lo sviluppo in età adolescenziale, la mineralizzazione ossea deve avvenire mantenendo un’adeguata concentrazione ematica degli ioni calcio e fosfato, la presenza di ferite deve favorire la rigenerazione ossea solo a livello locale.
In campo odontoiatrico l’argomento risulta di particolare interesse per parecchie branche dove vengono attualmente utilizzate le scoperte effettuate, inoltre si ipotizzano ulteriori impieghi in altri campi grazie all’applicazione delle attuali conoscenze e a eventuali progressi.
[Growth factor delivery for oral and periodontal tissue engineering
Darnell Kaigler, Joni A Cirelli, and William V Giannobile]
Ad esempio nell’implantologia e nella chirurgia vengono già utilizzate tecniche che sfruttano le conoscenze biochimiche tuttora acquisite.
[Guided tissue regeneration in jawbone defects prior to implant placement.
Lang NP1, Hämmerle CH, Brägger U, Lehmann B, Nyman SR.]
Oltre alle BMPs, fattori di crescita ossei molto specifici, da tempo sono stati scoperti fattori di crescita molto piu’ generici che ricoprono funzioni importanti non solo per la rigenerazione e il rimodellamento ossei ma anche per la guarigione delle ferite.
Questi fattori sono :PDGF, TGF- ,IGF,VEGF,EGF.
[Expression of four growth factors during fracture repair.
Bourque WT1, Gross M, Hall BK.]
Ognuno di essi è in grado di stimolare varie reazioni β nei tessuti ossei e non ,dipendenti anche dalle concentrazioni e dal loro andamento temporale; infatti all’inizio del processo riparativorigenerativo della ferita possono avere un significato, mentre più avanti nella guarigione o in presenza di più fattori di crescita assumono per le cellule significati biochimici differenti.
Tutto ciò che non deve far pensare che un controllo completo e ottimale dei fattori di crescita possa portare a un controllo della rigenerazione e del rimodellamento osseo, infatti questi segnali biochimici sono solo in grado di indicare alle cellule bersaglio ciò che è necessario esse facciano ma per avere dei risultati ottimali è necessaria la presenza di cellule specifiche a attuare i segnali biochimici dei fattori di crescita, la presenza di un substrato in grado di fornire una base per la formazione e il rimodellamento di tessuto e la presenza di un sufficiente grado di ossigenazione tissutale indispensabile per qualsiasi processo metabolico.
Quindi un controllo stretto e preciso dei fattori di crescita è indispensabile per ottenere dei buoni risultati ma sono anche necessarie altre condizioni per raggiungere gli obiettivi prefissati di un’ottimale rigenerazione ossea.
Attualmente vengono sperimentate tecniche in grado di ovviare ai problemi fin ora riscontrati che sfruttano la combinazione di trapianti ossei all’applicazione di Plasma Ricco di Piastrine (PRP); questa tecnica presenta il vantaggio di abbinare la presenza di un substrato e di cellule reattive ai fattori di crescita stessi (PRP): i fattori di crescita rilasciati dalle piastrine agirebbero direttamente sulle cellule presenti il trapianto che favorirebbero quindi l’osteointegrazione.
Ulteriori osservazioni hanno messo in luce il fatto che delle ceramiche abbiano la capacità di indurre e guidare la sostituzione delle stesse con osso proprio: le caratteristiche morfologiche e chimiche di porosità e biocompatibilità favorirebbero la deposizione di BMPs sulla superficie della ceramica e l’attacco da parte di cellule pronte a demolire la ceramica e sostituirla con tessuto osseo neo formato.
Ci si aspettano,infatti, grandi risultati dagli studi effettuati sulle BMPs stesse perchè sono dei segnali molto specifici di deposizione, calcificazione e rimodellamento della matrice ossea, capaci, probabilmente, non solo di indurre produzione ossea ma anche da fungere come segnale di migrazione per le cellule interessate nella produzione di un nuovo tessuto osseo.
[Growth factors and the regulation of bone remodeling.
E Canalis, T McCarthy, and M Centrella]
PRP

Il plasma ricco di piastrine può essere utilizzato nel campo della chirurgia ortopedica, della chirurgia orale e dalla chirurgia maxillo-faciale per la rigenerazione di tessuto osseo in sedi in cui esso risulti deficitario.
Si è osservato che le proprietà delle piastrine e dei fattori di crescita dalle stesse prodotti e secreti giocano un ruolo importante non solo nell’emostasi ma anche nei meccanismi di generazione di tessuto osseo; di qui l’idea di sfruttarne le potenzialità per il processo di rigenerazione del tessuto osseo.
[Marx RE, Carlson ER, Eichstaedt RM, Schimmele SR, Strauss JE,
Georgeff KR. Platelet-rich plasma: growth fator enhancement for bone grafts. Oral Surg Oral Pathol 1998;85:638-46]

Si è supposto, infatti, che l’impiego del PRP potrebbe migliorare e accelerare i meccanismi di attecchimento degli innesti ossei autologhi utilizzati per la correzione dei difetti.
Su queste basi si è deciso di confrontare l’efficacia elettiva del PRP in soggetti sottoposti a trapianti ossei autologhi per poter verificare i risultati elettivi di questa pratica chirurgica.
[Shanaman R, Fillstain MR, Danesh- Meyer MJ localized ridge augmentation using GBR and platelet –
rich plasma: case reports. Int J Periodontics Restorative Dent 2001; 21(4):345-55]
Le procedure nelle quali è stata descritta l’applicazione del PRP in chirurgia orale sono le seguenti: la rigenerazione ossea guidata orizzontale e verticale, l’elevazione del seno mascellare, la chiusura di perforazioni del mucoperiostio sinusale, l’associazione a innesti ossei particolati, l’accelerazione della guarigione dei tessuti molli e il trattamento dei difetti ossei dovuti a malattia parodontale.
[Tozum TF, Demirald B. Platelet rich in plasma : a promising innovation in dentistry. J Can Dent Assoc 2003:69 :664-70]
Nei casi di rialzo di seno mascellare, il PRP può assolvere una triplice funzione.
E’ in grado di fungere da agente riparatore di un’eventuale perforazione della membrana del seno mascellare, complicanza che può verificarsi durante la procedura di elevazione del seno mascellare a scopo implantologico nel 10-20% circa dei casi. In questa eventualità può essere utilizzata una membrana formata da gel PRP al quale, oltre a fungere da barriera, stimola la crescita sia della mucosa sinusale(favorendo quindi la riparazione della perforazione) che del versante osseo.

Il PRP rilascia fattori di crescita anche a livello del versante esterno in corrispondenza della finestra ossea d’accesso al seno mascellare.
Si pensa che questa caratteristica possa accelerare i fenomeni di attecchimento dell’innesto e del mucoperiostio del lembo di accesso, sigillando meglio l’incisione chirurgica e accelerandone la cicatrizzazione.
Seconda proprietà del PRP è il mantenimento della coesione dell’osso autologo particolato, favorendone l’attecchimento. Si crea, infine, un effetto barriera a livello dell’osteotomia di accesso, evitando un’eccessiva dispersione del materiale da innesto inserito.
Nelle tecniche di rigenerazione ossea guidata associate a PRP, vengono seguiti i principio delle rigenerazione ossea guidata tradizionale con l’unica differenza che all’osso autologo particolato viene miscelato il gel piastrinico. In questa maniera si riescono a ottenere una rapida stabilizzazione dell’innesto e la sua successiva sostituzione con tessuto osseo neoformato.
L’incremento locale di fattori di crescita autologhi ottenuto con una procedura relativamente semplice rappresenta una metodica interessante. I dati ottenuti a oggi sono incoraggianti. Il vantaggio clinico offerto da PRP sta nell’accelerazione della rigenerazione ossea incrementando la quota di alcuni fattori di crescita necessari alla rigenerazione tissutale.
"[Chiapasco M, Moriguchi HF, Boisco M, Scuppa L.Impiego clinico in chirurgia orale del plasma ricco
di piastrine.Implantologia Orale 2004;1:7-21]"
Tuttavia bisogna sottolineare che i fattori di crescita noti contenuti nelle piastrine hanno un effetto definito “cronotropo positivo” solo nelle fasi iniziali della guarigione.
A distanza di tempo la qualità del tessuto osseo trapiantato/rigenerato è simile a quella ottenuta con altre tecniche che non prevedono l’uso di PRP.
"[Nanci A, Orsini G. I fattori di crescita ed il loro ruolo nelle riparazione ossea. In : De Franco , Fornara R, Piattelli A,Mangano C- fattori di crescita e biomateriali – Milano:Masson 2000]"
Va poi considerato il fatto che la presenza di fatori di crescita in sè non è sufficiente; è necessaria un’adeguata quota cellulare, la vera responsabile della produzione della matrice organica ossea.
Queste cellule preosteoblastiche possono essere presenti nel sito dove avverrà l’innesto, ma un’ulteriore aggiunta è auspicabile.
E’ per quest' ultimo motivo che è importante apportare anche dell’osso autologo particolato.
Un innegabile vantaggio è invece rappresentato dall’effetto positivo sulla guarigione dei tessuti molli, con riduzione dei rischi di deiescenza delle ferite chirurgiche e conseguente rischio di infezione del tessuto osseo trapiantato.
L’utilizzo del PRP è indicato per tutti i pazienti, ma pare particolarmente efficace in quelli che presentano capacità rigenerative ridotte come anziani, pazienti con osteoporosi, pazienti radioterapizzati, pazienti diabetici.
La breve vita media delle piastrine presenti nell’innesto di PRP rappresenta un fattore limitante la reale efficacia di questo composto.
Generalmente le piastrine vanno incontro a degranulazione dell’arco di 3-5 giorni e l’attività dei fattori di crescita in essi presenti si esaurisce antro7 -10 giorni.
La semplicità della tecnica di ottenimento e di veicolazione dell’innesto di PRP rappresenta un fattore che da punto di vista pratico può non essere trascurato e, come già accennato vanno sottolineate le caratteristiche di atossicità e non immugenicità del PRP in quanto si tratta di materiale autologo.
Un altro fattore è legato al tipo di apparecchio utilizzato per l’ottenimento del PRP, in quanto si è visto che la concentrazione finale puo variare in modo molto rilevante, potendo pertanto influenzare il risultato.
Con le macchine aperte si ottiene infatti una concentrazione piastrinica del 10-250, inferiore a quella ottenibile con le macchine chiuse250-400% che hanno anche i vantaggi di garantire una minore contaminazione del materiale, un minore rischio d’attivazione precoce con degranulazione e perdita di efficacia dei fattori di crescita e un minor rischio di attivazione osteoclastica.
In letteratura sono presenti studi che hanno lo scopo di definire istruzioni piu’ precise circa i protocolli per l’ottenimento di concentrato piastrinico, sia per quanto riguarda la quantità del sangue da prelevare la paziente che per le procedure di centrifugazione e separazione della frazione piastrinica.
E’ inoltre necessario chiarire ulteriormente alcuni aspetti delle piastrine , del loro ciclo vitale e degli effetti correlati alla loro attività.
E’ stato dimostrato che un innesto di osso particolato associato a PRP ha un grado di consolidamento, densità e maturità ossea notevolmente incrementato rispetto a un innesto di solo osso particolato.
Inoltre i tempi di attecchimento e di maturazione dell’innesto osseo sono molto più rapidi.
Va comunque rilevato che, a distanza di tempo, un osso innestato con tecniche di prelievo osseo autologo o distrattive raggiunge un grado di funzionalità paragonabile a quello dell’osso incrementato con PRP.Si osserva cioè un’accelerazione della guarigione nelle fasi iniziali, periodo in cui i fattori di crescita piastrinici sono più attivi.
La necessità di eseguire dai pazienti prelievi di notevoli quantità di sangue (450-500ml) può essere considerata un altro fattore negativo. Si ipotizza che tale condizione possa sottoporre il paziente a uno stress significativo dell’apparato cardiocircolatorio, in particolare se consideriamo che un innesto osseo con PRP è indicato in pazienti che possono essere compromessi dal punto di vista sistemico. Sono attualmente in corso studi mirati a ottenere un concentrato piastrinico efficace, ma che sia ottenibile con prelievi di minori volumi ematici.
[Platelet-rich plasma preparation for regenerative medicine: optimization and quantification of cytokines and growth factors
Paola Romina Amable,corresponding author1 Rosana Bizon Vieira Carias,1 Marcus Vinicius Telles Teixeira,1 Ítalo da Cruz Pacheco,1 Ronaldo José Farias Corrêa do Amaral,2 José Mauro Granjeiro,3 and Radovan Borojevic1]
[Development of a cost-effective method for platelet-rich plasma (PRP) preparation for topical wound healing
K. Akhundov, G. Pietramaggiori, l. Waselle, S. Darwiche, S. Guerid, C. Scaletta, N. Hirt-Burri, L.A. Applegate and W.V. Raffoul]
[Effectiveness of Two Methods for Preparation of Autologous Platelet-Rich Plasma: An Experimental Study in Rabbits
Maria J. H. Nagata,a Michel R. Messora,b Flávia A. C. Furlaneto,a Stephen E. Fucini,a Alvaro F. Bosco,a Valdir G. Garcia,a Tatiana M. Deliberador,c and Luiz G. N. de Melod]
# Vantaggi
* Accelerazione delle fasi iniziali di consolidamento dell’innesto osseo particolato importante sopratutto
in soggetti con turn-over tissutale rallentato:anziani, diabetici, ecc
* Incremento della densità e maturità dell’innesto osseo(solo fasi iniziali)
* Atossicità e non immunogenicità
* Semplicità della tecnica di ottenimento e di veicolazione
* Accelerazione dei tempi di cicatrizzazione dei tessuti molli
* Riduzione dei rischi d’infezione dell’innesto osseo
* Riduzione del rischio di deiescenza delle ferite chirugiche
* Possibilità di utilizzo sotto forma di membrana biologica riassorbibile
# Svantaggi
* Necessità di apparecchiatura idonea
* Necessità di associare PRP a innesti di osso autologo
* Breve vita media delle piastrine
PDGF
Il PDGF è una glicoproteina con un peso molecolare di 30 kD, viene sintetizzato nei megacariociti, cellule precursori delle piastrine, e in seguito immagazzinato nelle piastrine stesse.
Inoltre la presenza di questa molecola è stata riscontrata anche in altre tipologie tissutali quali macrofagi, cellule endoteliali e fibroblasti.
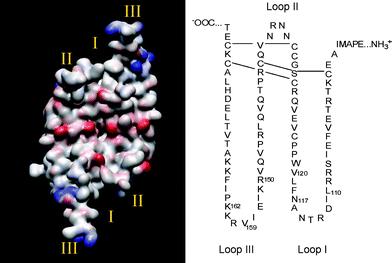 La struttura più comune è la forma eterodimerica: composta da due catene polipeptidiche chiamate “A” e”B”, rispettivamente formate da 121 e 125 amminoacidi.
La struttura più comune è la forma eterodimerica: composta da due catene polipeptidiche chiamate “A” e”B”, rispettivamente formate da 121 e 125 amminoacidi.
Nelle piastrine umane sono presenti anche forme omodimeriche (A-A,B-B) che esercitano gli stessi effetti biologici delle
catene eterodimeriche.
A livello locale il PDGF è in grado di promuovere differenti processi del metabolismo cellulare, in particolare quello di
angiogenesi; sono pertanto evidenti gli effetti positivi di tale molecola nella guarigione delle ferite.
Il PDGF è concentrato nel sito della lesione tissutale in seguito al processo di degranulazione delle piastrine, si ritiene che la concentrazione media sia di 0,06 ng per milione di piastrine( ogni piastrina conterrebbe quindi 6×10 -20g ovvero 1700
molecole).
Il PDGF agisce su un target cellulare specifico a livello della membrana cellulare della cellula bersaglio, costituito da due
recettori denominati e rispettivamente. Tali recettori sono a loro volta collegati a un sistema a ß chinasico che ha funzione di fosforilare un secondo messaggero intracellulare. Il segnale intracellulare ha a sua volta il compito di attivare, a livelo
nucleare, l’espressione genetica di sequenze codificanti proteine coinvolte nella regolazione dei processi cellulari, quali
mitosi,angiogenesi e attivazione macrofagica. Entrambi i recettori a e ß sono in grado di legare le catene B.Le catene A sonoinvece in grado di interagire solo con i recettori a.
Questi recettori stimolano l’attività mitotica, mentre solo il recettore stimola la chemiotassi, sopratutto ß dei precursori dellecellule osteoblastiche. Inoltre, si ha la stimolazione della mitogenesi e della differenziazione di fibroblasti a livello dei tessutimolli.
[Gruber R, Varga F, Fisher MB, Watzek G. Platelets stimulate proliferation of bone cells: involment of
platelet-derived growth factor, microparticles and membranes. Clin Oral Impl Res 2002; 13:349-9]
Il PDGF è coinvolto anche nei meccanismi di riassorbimento osseo, anche se la sua esatta funzione in tale processo non èancora stata ben chiarita.
Per quanto riguarda gli osteoblasti, si ha un’azione netta in favore della replicazione dei precursori di questi tipi cellulari. Si ha pero’ anche una concomitante inibizione della differenziazione e della funzione osteoblastica.
Ad ogni modo è chiara la funzione del PDGF nei processi di guarigione delle ferite ossee.
[Effect of PDGF, IGF-1 and PRP on the implant osseointegration. An histological and immunohistochemical study in rabbits.Ortolani, Guerriero, Coli, Di Giannuario, Minniti, Polimeni]
Da quanto analizzato emerge che il PDGF è un potente mitogeno, ma non ricopre funzioni differenziative o morfogenetichenei confronti del tessuto osseo.
Il ruolo e la rilevanza dell’impiego clinico del PDGF, in particolare quello contenuto nelle piastrine sono suggeriti dal ruoloche questo fattore di crescita ha nella guarigione della ferite e della riparazione delle fratture.
Si ritiene , inoltre , che il PDGF abbia un ruolo particolarmente importante nelle situazioni in cui si ha riparazione ossea inseguito a condizioni infiammatorie acute, in quanto la sua azione mitogenica è esaltata dalla presenza di altre citochine presenti durante tale processo.
Fattore di crescita trasformante β : TGF-β

Il TGF-β è la molecola capostipite della superfamiglia dei fattori di crescita TGF-β della quale fanno parte anche le BMP, le activine, le inibine, la sostanza inibitoria mülleriana, fattori di crescita di differenziazione (GDFs). Tali sottogruppi differenziano leggermente tra di loro per sequenza amminoacidica e funzioni.
Sono state identificate quattro distinte isoforme di TGF-β1,-2,-3, e -5.
[Growth factors for bone growth and repair: IGF, TGF beta and BMP.
Linkhart TA1, Mohan S, Baylink DJ.]
Le TGF-β sono secrete in forma biologicamente inattiva o latente: la loro attivazione avviene a opera di variazioni di pH o da parte di agenti caotropici. E’ stato dimostrato che la plasmina è in grado di attivare la forma latente di TGF-β (LTGF-β) con un clivaggio proteolitico del precursore, tale azione puo’ essere, inoltre incrementata dalla presenza di retinoidi. Un altro attivatore è la trombospondi, tale processo avviene in due stadi: il primo coinvolge il legame della forma latente alla trombospondina; il secondo comporta il rilascio della forma attiva.
Le TGF-β, nella loro forma latente, hanno la caratteristica peculiare di essere associate a una proteina (Latent TGF-β Binding Protein, LTBP) la cui funzione è quella di veicolare il fattore di crescita, ma non solo.
Si è osservato che la LTBP è una proteina strutturale della matrice osteoide, quindi importante nel processo di formazione del tessuto osseo.Mutazioni genetiche del gene LTBP sono all’origine di patologie a carico del tessuto connettivo inclusa la sindrome di Marfan.
Le TGF- a differenza delle BMP che sono in grado di indurre osteogenesi in siti ectopici, sono in grado di indurre la formazione di tessuto osseo solo se poste in stretto contatto con l’osso.
Analogalmente al PDGF, le TGF-β vengono sintetizzate da diverse tipologie cellulari quali PLTS, macrofagi, osteoblasti, linfociti e granulociti neutrofili. Oltre al coinvolgimento nei processi di sviluppo del tessuto osseo, le TGF-β sono più in generale in grado di svolgere funzioni di controllo nei processi di crescita cellulare, di stimolazione nella produzione di matrice extracellulare e di inibizione del sistema imunitario. In particolare è stato dimostrato che il TGF-β presenta effetti negativi nei confronti della formazione di tessuto cicatriziale e fibrosi.
[Neutralisation of TGF-beta 1 and TGF-beta 2 or exogenous addition of TGF-beta 3 to cutaneous rat wounds reduces scarring-M. Shah,D.M. Foreman and M.W. Ferguson]
Vi sono degli agenti importanti per la formazione ossea che sono in grado di incrementare il contenuto di TGF-β nella compagine ossea.Tale caratteristica è stata riscontrata anche nel fattore di crescita simil-insulinico.
In osteoblasti in coltura è stato riscontrato un importante ruolo nella chemiotassi, proliferazione, differenziazione e regolazione della produzione di proteine della matrice extracellulare ossea. In alcuni modelli sperimentali si è osservata un’inibizione della proliferazione cellulare, fenomeno probabilmente influenzato dallo stadio differenziativo cellulare.
[TGF beta regulation of cell proliferation.
Moses HL1, Arteaga CL, Alexandrow MG, Dagnino L, Kawabata M, Pierce DF Jr, Serra R.]
Va poi rilevato che il TGF-β, anche se in grado di stimolare la formazione di matrice osteoide, possiede allo stesso tempo la proprietà di indurre mineralizzazione. Pertanto una volta che ha svolto la sua funzione di promotore della formazione ossea, il TGF-β deve essere rimosso.
Nei confronti dell’attività osteoclastica, il TGF-β ha un effetto netto di inibizione del riassorbimento osseo. Infine è stato dimostrato che il TGF-β è in grado di indurre apoptosi degli osteoclasti maturi.
[Transforming growth factor-beta1 (TGF-beta1) induces human osteoclast apoptosis.Houde N1, Chamoux E, Bisson M, Roux S.]
Per quanto riguarda gli effetti in vivo , il TGF-β come gia’ accennato, non è in grado di produrre osso in siti ectopici,ma se cobinato con matrice ossea demineralizzata, si osserva un’accelerazione del processo di osteoinduzione.
Attualmente sono stati identificati tre tipi di recettori TGF-β : tipo I, tipo II e tipo III.
I recettori tipo I e II appaiono essere i veri responsabili della traduzione del segnale intracellulare.Il recettore di tipo III conosciuto con il nome di betaglicano, pare che svolga la funzione di concentrare il ligando prima della presentazione di quest’ultimo ai due recettori I e II, svolgendo cosi’ una funzione regolatrice.
A livello intracellulare è stata identificata una chinasi proteica, TAK1, che funge da mediatore.TAK1 è un membro ben distinto dagli altri membri della famiglia proteinchisi fitogeno-attive (MAPK).Pare che questa proteina sia coinvolta anche nei processi di segnalazione intracellulare delle BMP e di altri membri della superfamiglia delle TGF-β sono tuttora in studio.
Tutti e tre i tipi recettoriali sono presenti negli osteoblasti e la loro rispettiva proporzione sulla membrana cellulare viene modificata da fattori osteotropici, tra cui l’ormone paratiroideo e le BMP, modificando pertanto il profilo di interazione fattore di crescita –recettore.
Vi sono dati che suggeriscono la presenza di due distinte vie a livello delle TGF-β negli osteoblasti. Tali studi suggeriscono che la via che passa attraverso il recettore di tipo II renda la cellula in grado di uscire dall’effetto proliferativo delle TGF-β.
L’effetto che stimola la intesi di fibronectina è invece sotto il controllo del recettore I.
Da ciò si desume che la combinazione dei recettori sulla superficie osteoblastica determina la risposta di queste cellule ai fattori di crescita.
A livello osseo, gli effetti cellulari diretti più importanti delle TGF-β sono la funzione chemiotattica e citogenetica, poiché attivano in senso osteoproduttore preosteoblasti, cellule pluripotenti e fibroblasti, la stimolazione della deposizione della matrice osteoide e in fine formazione di osso.Inoltre agiscono da mediatori nel rimodellamento osseo e nelle maturazioni di un innesto osseo inibendo l’attività osteoclastica.
Va però detto che, a differenza delle BMP, le TGF-β non sono però in grado di promuovere la formazione di tessuto osseo in siti di trapianto ectopici, come ad esempio a livello del tessuto muscolare.
Fattore di crescita insulino-simile : IGF

Il fattore di crescita insulino-simile ( Insulin-Like Growth Factor , IGF) è un fattore di crescita molto importante nella promozione della crescita e nel mantenimento del tessuto osseo. Analogamente ad altri fattori di crescita coinvolti nel metabolismo osseo, l ‘IGF è una proteina che è presente in tale tessuto in seguito a processi di sintesi “de novo” e immagazzinamento.
[Insulin-Like Growth Factor (IGF) and Bone,Thomas L. McCarthy, Michael Centrella]
Le modalità di azione sono di tipo autocrino/paracrino; inoltre ca presa in considerazione una possibile azione di tipo ormonale, quindi di veicolazione tramite il circolo sanguigno.
Sino ad ora sono state classificate due varietà di IGF: tipo I e tipo II. Si tratta di proteine di basso peso molecolare (7,7kD e 7,5 kD rispettivamente) prodotte dagli osteoblasti, ma che si trovano contenute anche nella matrice ossea e nelle piastrine.
Vi sono dati che insicano che estrogeni, la forscolina (un potente induttore di AMP ciclico) e le TGF-β sono in grado di incrementare la produzione di IGF-I.
L ‘IGF-II è il fitogeno più abbondante prodotto dagli osteoblasti umani. Si sa ancora poco circa la sua regolazione, ma è certo che altri fattori osteotropici, quali le BMP, ne sono importanti regolatori locali.
In uno studio effettuato su umani affetti da osteoartrite fu osservato che l’mRNA dell’ IGF-II, e quindi la produzione proteica, era più elevata rispetto all’IGF-I, e che l’espressione di entrambi era maggiore nelle sedi dove gli osteoblasti erano attivamente coinvolti nella produzione di matrice osteoide. Lo stesso dato fu osservato nella guarigione da fratture ossee.
Questi dati che confermano la differente produzione di GF nei diversi tipi di differenziazione delle cellule della linea osteoblastica, indicano che l’IGF è fortemente implicato nei processi di rimodellamento osseo.
[Insulin-like growth factor (IGF) receptor, IGF-I, interleukin-1 beta (IL-1 beta), and IL-6 mRNA expression in osteoarthritic and normal human cartilage.
Middleton J1, Manthey A, Tyler J.]
Gli effetti dell ‘IGF sono mediati dal suo legame a un recettore specifico di membrana che è stato identificato in diversi modelli sperimentali impieganti cellule. Analogamente sono stati identificati due tipi di recettori di tipo I e tipo II.
Il recettore di tipo I è una tirosino-chinasi strutturalmente simili al recettore dell’insulina. Questo recettore ha affinità maggiore per l’IGF-I e, in ordine decrescente, per l ‘IGF-II e in fine per l’insulina.
Il recettore di tipo II è identico al recettore del mannoso-6-fosfato. Questo recettore lega l’IGF-II e gli enzimi lisosomiali con notevole affinità, mentre non è in grado di interagire con l’insulina. Non presenta attività di fosforilazione, ma è coinvolto nei processi di internalizzazione recettore-mediana. Partecipa,inoltre, all’attività di separazione e traffico lisosomiale.
In modelli di osteoblasti in vitro si è osservato che l’IGF ha la capacità di incrementare la sintesi di DNA e la proliferazione cellulare. Stimola, altresì, la funzione degli osteoblasti maturi nella produzione di matrice osteoide, promuove le sintesi di collagene e inibisce la sua degradazione a opera di proteasi.
Si pensa che l’IGF, in particolare l’IGF-I, agisca in modo bimodale comportandosi come fitogeno in maniera paracrina e come stimolante della produzione di matrice ossea e dela mineralizzazione a seconda dello stadio di differenziazione delle cellule osteoblastiche.
Gli effetti locali dell’IGF-I che sono stati osservati in vivo sono correlati al pattern di espressione che tale gene possiere.
L'’IGF-I, pertanto, è correlato ai processi di osteogenesi.
Vi sono infine studi molto interessanti che mettono in correlazione l’espressione dell’ IGF ai carichi meccanici a cui l’osso è sottoposto. In tali studi viene sottolineata la funzione strategica degli osteociti come dispositivi in grado di rilevare il carico meccanico applicato all’osso e come in seguito a questa rilevazione vi sia un aumento di produzione di IGF.
[Anatomo fisiologia dell'osso e della cartilagine. Cabitza P. Esculapio]
Anche l’IGF presenta delle Binding Proteins (IGFBPs), il cui ruolo è fondamentale nella risposta cellulare in vivo. Le IGFBP hanno elevata affinità di legame con l’IGF e il loro effetto è quello di inibire l’iterazione del fattore di crescita con il suo recettore di membrana, inibendone pertanto l’attività osteotropica. Va comunque sottolineato che attribuire un effetto fisiologico netto a ogni IGFBP non è possibile, in quanto sono stati osservati diversi effetti secondo il modello sperimentale preso in considerazione, Inoltre la risposta è influenzata anche dal fenotipo cellulare, dalla presenza di altre IGFBP e IGF, da alterazioni post traduzione proteica, da interazioni con la matrice extracellulare e con altre citochine.
La regolazione della produzione di IGFBP è sotto il controllo di effettori sistemici e locali del metabolismo osseo inclusi il PTH, estrogeni, 1,25(oh)2D3, glucocorticoidi, insulina, ormone della crescita, acido retinico, prostaglandine,
BMPs,PDGF,IGF,TGF- fattori di crescita β fibroblastico basico.
L’iterazione dell' IGF con il suo recettore presente sulle cellule osteoblastiche stimola la sintesi di DNA e la conseguente produzione di proteine della matrice cellulare. L’osteoblasto secerne anche le IGFBP e le loro rispettive proteasi e il complesso IGF.IGFBP viene così immagazinato nella matrice extracellulare. Tale meccanismo avviene anche per le TGF-β.
In questo stato, cosiddetto basale, le cellule osteoblastiche non sono in grado di rispondere all’azione stimolatoria dell’IGF.
Un’alterazione di questa situazione, come ad esempio accade nel corso dei processi di riassorbimento osseo a opera degli osteoclasti, è in grado di attivare le proteasi, come ad esempio accade nel corso dei processi di riassorbimento osseo a opera
degli osteoclasti, è in grado di attivare le proteasi delle IGFBP, permettendo la liberazione della forma attiva di IGF. Inoltre, si pensa che il riassorbimento osseo contribuisca a liberare altri fattori di crescita immagazzinati dell’osso stimolando ulteriormente la rigenerazione ossea.
Proteine morfogenetiche dell'osso: LE BMP

Le BMP sono proteine che appartengono alla duperfamiglia dei TGF- , il genoma umano codifica per β 20 di queste proteine.
Ogni BMP nella forma attiva è un dimero, costituito da due subunità identiche(monomeri) , legate tra loro da ponti disolfuro tra fette residui amminoacidici di cisteina, che si trovano nella posizione carbossilica terminale, area di fondamentale importanza per l’attività biologica della proteina. Ogni monomero è costituito da circa 120 amminoacidi.
Nella famiglia delle BMP umane le più importanti sono certamente le BMP-2, BMP-3,BMP-4 e BMP-7 che sono implicate nella morfogenesi del tessuto osseo e cartilagineo sia durante l’età dell' sviluppo sia nell’età adulta in caso di fratture, inoltre sono coinvolte nella morfogenesi di altri organi e tessuti come il rene, il cuore e anche i denti.
 Le BMP vengono prodotte in loco o richiamate dal circolo e agiscono in modo autocrino e paracrino. L’azione si basa sull’interazione con recettori di tipo serin-treonin-cinasico BMPR. Sono prodotte dagli soteoblasti ed hanno un ruolo essenziale nell’osteogenesi regolando l’espressione del gene Osf/cbfa1( osteoblast specific factor/ core Binding Factor 1) sul cromosoma 6 che regola la differenziazione delle cellule in osteoblasti e più in generale di quelle cellule implicare nella generazione dei tessuti mineralizzati.
Le BMP vengono prodotte in loco o richiamate dal circolo e agiscono in modo autocrino e paracrino. L’azione si basa sull’interazione con recettori di tipo serin-treonin-cinasico BMPR. Sono prodotte dagli soteoblasti ed hanno un ruolo essenziale nell’osteogenesi regolando l’espressione del gene Osf/cbfa1( osteoblast specific factor/ core Binding Factor 1) sul cromosoma 6 che regola la differenziazione delle cellule in osteoblasti e più in generale di quelle cellule implicare nella generazione dei tessuti mineralizzati.
La mancata espressione di un allele di Cbfa1 è causa nell’uomo della displasia cleido-cranica(bassa statura, aplasia clavicolare,fontanelle craniche aperte e denti soprannumerari); l’ablazione di tale gene comporta il blocco della formazione dell’osso e dei tessuti dentali, ma non del tessuto cartilagineo.
Attualmente c’è grosso interesse riguardo i possibili utilizzi delle BMP, sopratutto per quanto concerne la chirurgia maxillofaciale e le protesi a supporto implantare.
E' stato dimostrato che l’utilizzo di BMP permette l’ottenimento di buoni risultati nell’integrazione degli impianti dentali in tempi molto contenuti rispetto a quelli normalmente necessari; inoltre le tecniche con BMP permettono la risoluzione di difetti anche di grosse dimensioni, cosa non ottenibile durante una guarigione spontanea.
[Effect on bone healing of bone morphogenetic protein placed in combination with endosseous implants: a pilot study in beagle dogs.
Fiorellini JP1, Buser D, Riley E, Howell TH.]
Sempre a proposito della chirurgia implantare, le BMP hanno reso superfluo l’utilizzo di supporti quali membrane e viti di fissaggio (utlizzati in origine per dare supporto provvisorio all’osso in fase di formazione), rendendo cosi più semplici le manovre operatorie e diminuendo nettamente il tasso di insuccesso.
L’utilizzo di BMP sembra pero’ non fermarsi al già ampio campo della chirurgia, in quanto sono in corso studi per la valutazione di tale trattamento anche in campo restaurativo.
In particolare si è notato che la BMP-2 ha la capacità di stimolare la differenziazione di cellule staminali pulpari in odontoblasti, promuovendo la deposizione di dentina e conducendo quindi alla rigenerazione delle porzioni dentali danneggiate in seguito a processi cariosi o intervento strumentale. Il limite di questa tecnica risiede pero’ nel fatto che il numero di cellule staminali a livello pulpare è piuttosto esiguo, o in ogni caso non sufficiente a garantire la deposizione di masse di dentina idonee.
[Bone morphogenetic protein-7 (osteogenic protein-1, OP-1) and tooth development.
Helder, Karg H, Bervoets TJ, Vukicevic S, Burger EH, D'Souza RN, Wöltgens JH, Karsenty G, Bronckers AL.]
Il processo consiste nell’inserire, all'interno della camera pulpare, dei frammenti di polpa trattati con BMP-2 . Questa sorta di trapianto autologo fornisce le cellule staminali che differenzieranno in odontoblasti, producendo dentina secondaria e riparando i tessuti danneggiati.
[Dentin regeneration by dental pulp stem cell therapy with recombinant human bone morphogenetic protein 2.
Iohara K1, Nakashima M, Ito M, Ishikawa M, Nakasima A, Akamine A.]
Questi frammenti di polpa, chiamati pellets, si sono dimostrati notevolmente più efficaci rispetto a colture monostrato di cellule, che venivano poi trapiantate all’interno della camera pulpare. Cio’ probabilmente a causa della tridimensionalità dei pellets e della presenza di abbondante tessuto connettivo e matrice extracellulare, che costituiscono una primitiva impalcatura per la dentina in fase di formazione, oltre che un buon veicolo per il rilascio e la trasmissione del segnale della BMP-2.
L’obiet